مقدمه
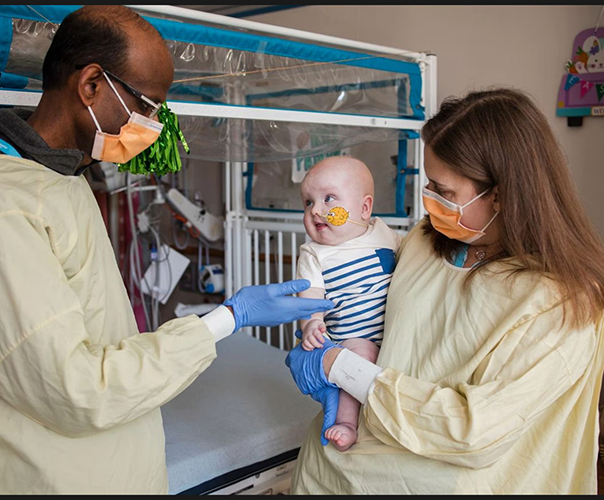
در یکی از برجستهترین دستاوردهای پزشکی سال ۲۰۲۵، تیمی از پزشکان بیمارستان کودکان فیلادلفیا و دانشگاه پنسیلوانیا موفق شدند با استفاده از فناوری ویرایش ژن CRISPR، DNA یک نوزاد مبتلا به بیماری ژنتیکی نادر کمبود آنزیم CPS1 را بازنویسی کنند. این نوزاد، که با نام KJ شناخته میشود، پس از دریافت درمان سفارشیشده، نشانههای امیدوارکنندهای از بهبود نشان داده است. این دستاورد نهتنها زندگی KJ را بهبود بخشیده، بلکه راه را برای درمان سایر بیماریهای ژنتیکی نادر هموار کرده است.
بیماری کمبود آنزیم CPS1 چیست؟
کمبود آنزیم CPS1 (Carbamoyl Phosphate Synthetase 1) یک اختلال ژنتیکی نادر است که تنها یک نفر از هر ۱.۳ میلیون نفر را تحت تأثیر قرار میدهد. این بیماری به دلیل جهش در ژن مسئول تولید آنزیم CPS1 ایجاد میشود، که برای تبدیل آمونیاک به اوره در کبد ضروری است. بدون این آنزیم، آمونیاک در بدن تجمع مییابد و به کبد، مغز و سایر اندامها آسیب میرساند. حدود نیمی از نوزادان مبتلا به این بیماری در هفته اول زندگی فوت میکنند و بازماندگان اغلب با تأخیرهای رشدی شدید و نیاز به پیوند کبد مواجه میشوند.
جدول اطلاعات بیماری CPS1
| ویژگی | توضیحات |
| شیوع | ۱ در ۱.۳ میلیون نفر |
| علت | جهش در ژن تولیدکننده آنزیم CPS1 |
| علائم | تجمع آمونیاک، آسیب به کبد و مغز، تأخیر رشدی |
| نرخ مرگ و میر | حدود ۵۰٪ در هفته اول زندگی |
| درمان سنتی | پیوند کبد، رژیم غذایی محدود |
فرآیند توسعه و اجرای درمان
پس از تشخیص بیماری در KJ، پزشکان بلافاصله کار روی یک درمان سفارشیشده را آغاز کردند. این فرآیند شامل مراحل زیر بود:
- شناسایی جهش ژنتیکی: پزشکان جهش خاص در ژن KJ (جهش Q335X) را شناسایی کردند که باعث کمبود آنزیم CPS1 شده بود.
- طراحی درمان: با استفاده از فناوری CRISPR و روش بازنویسی پایه (base editing)، درمانی طراحی شد که قادر به اصلاح دقیق این جهش بود.
- تولید و آزمایش ایمنی: درمان در کمتر از شش ماه تولید و آزمایش شد تا از ایمنی آن اطمینان حاصل شود.
- تزریق درمان: درمان در سه دوز (فوریه، مارس و آوریل ۲۰۲۵) از طریق نانوذرات چربی به کبد KJ تزریق شد.
- روش بازنویسی پایه امکان تغییر یک نوکلئوتید خاص در DNA را فراهم میکند، که در مقایسه با روشهای سنتی ویرایش ژن، دقت و ایمنی بیشتری دارد. استفاده از نانوذرات چربی نیز به انتقال مؤثر درمان به سلولهای کبدی کمک کرد.
نتایج درمان و وضعیت کنونی KJ
پس از دریافت سه دوز درمان، KJ بهبود قابلتوجهی نشان داده است. او اکنون میتواند پروتئین بیشتری در رژیم غذایی خود تحمل کند، که نشانهای از بهبود عملکرد کبد است. همچنین، نیاز او به داروهای کمکی برای حذف نیتروژن کاهش یافته است. با این حال، پزشکان تأکید دارند که KJ باید برای تمام عمر تحت نظارت پزشکی باشد تا اثربخشی درمان و هرگونه عوارض احتمالی بررسی شود. نتایج اولیه بسیار امیدوارکننده هستند، اما برای ارزیابی کامل اثرات بلندمدت، نیاز به پیگیریهای بیشتری است.
اهمیت این دستاورد برای پزشکی
این درمان بهعنوان اولین مورد استفاده از ویرایش ژن سفارشیشده برای یک بیمار انسانی شناخته شده است و نقطه عطفی در تاریخ پزشکی محسوب میشود. فناوری استفادهشده در این مطالعه، که توسط مؤسسه ملی سلامت (NIH) پشتیبانی شده است، میتواند بهعنوان یک پلتفرم برای توسعه درمانهای مشابه برای سایر بیماریهای ژنتیکی نادر عمل کند. این دستاورد نشاندهنده پتانسیل پزشکی شخصیسازیشده است، جایی که درمانها بهطور خاص برای جهشهای ژنتیکی منحصربهفرد هر بیمار طراحی میشوند.
جدول پتانسیلهای آینده فناوری ویرایش ژن
| کاربرد | توضیحات |
| بیماریهای ژنتیکی نادر | درمان جهشهای خاص در بیماریهایی مانند CPS1، فیبروز کیستیک و غیره |
| سرطان | هدفگیری جهشهای سرطانی برای درمانهای شخصیسازیشده |
| بیماریهای ارثی | اصلاح ژنهای معیوب قبل از بروز علائم |
| چالش ها | نیاز به نظارت بلندمدت، هزینههای بالا، مسائل اخلاقی |
نظرات کارشناسان
کارشناسان این دستاورد را گامی بزرگ در پزشکی ژنتیکی میدانند:
- دکتر ربکا آهرنز-نیکلاس، استاد کمکی پزشکی کودکان و ژنتیک در بیمارستان کودکان فیلادلفیا، اظهار داشت: «KJ تنها یک بیمار است، اما ما امیدواریم که او اولین نفر از میان بسیاری باشد که از این روش سود میبرند».
- پروفسور کیران موسونورو، استاد تحقیقات ترجمهای در دانشگاه پنسیلوانیا، تأکید کرد: «وعده درمان ژنی در حال تحقق است».
- دکتر میگل آنخل مورنو-ماتئوس افزود: «این یک نقطه عطف است که نشان میدهد این درمانها اکنون به واقعیت تبدیل شدهاند».
چالشها و ملاحظات اخلاقی
اگرچه این درمان موفقیتآمیز بوده است، اما چالشهایی نیز وجود دارد. اثرات بلندمدت ویرایش ژن هنوز بهطور کامل شناخته نشده است و نظارت مداوم برای شناسایی هرگونه عوارض احتمالی ضروری است. علاوه بر این، هزینههای بالای توسعه چنین درمانهایی و مسائل اخلاقی مرتبط با ویرایش ژن انسان، از جمله نگرانیهای مربوط به استفاده نادرست این فناوری، باید مورد توجه قرار گیرند. با این حال، موفقیت این درمان نشاندهنده پتانسیل عظیم فناوری CRISPR برای بهبود زندگی بیماران است.
نتیجهگیری
درمان KJ با استفاده از فناوری ویرایش ژن، نهتنها یک موفقیت پزشکی، بلکه نمادی از امید برای میلیونها نفر مبتلا به بیماریهای ژنتیکی نادر است. این دستاورد نشاندهنده قدرت علم در ایجاد تغییرات دقیق در DNA برای نجات جان انسانها است. با ادامه تحقیقات و پیشرفتهای فناوری، میتوان انتظار داشت که درمانهای مشابه در آینده به تعداد بیشتری از بیماران کمک کنند.
reference:
https://www.nejm.org/doi/full/10.1056/NEJMoa2504747
https://www.axios.com/2025/05/16/gene-editing-crispr-baby-first-patient-treatment
https://www.nytimes.com/2025/05/15/health/gene-editing-personalized-rare-disorders.html
https://cosmosmagazine.com/science/biology/gene-therapy-ultrarare-disease/