سندرم آنتیفسفولیپید آنتیبادی (APS) یک اختلال خودایمنی سیستمیک و نادر است که با حضور مداوم آنتیبادیهای آنتیفسفولیپید (aPL)، همراه با ترومبوز عروقی یا عوارض مرتبط با بارداری شناخته میشود. این بیماری برای اولین بار در دهه ۱۹۸۰ معرفی شد و از آن زمان تاکنون پژوهشهای گستردهای پیرامون آن صورت گرفته است. بر اساس دادههای معتبر تا نوامبر ۲۰۲۵، تخمین زده میشود که شیوع APS حدود ۵۰ مورد در هر ۱۰۰ هزار نفر بوده و میزان بروز سالانه آن به ۲.۱ مورد در هر ۱۰۰ هزار نفر میرسد. در میان افرادی که به لوپوس اریتماتوز سیستمیک (SLE) مبتلا هستند، خطر پیشرفت به APS بین ۵۰ تا ۷۰ درصد تخمین زده میشود.
تاریخچه و اپیدمیولوژی
سندرم آنتیفسفولیپید (APS) نخستین بار در سال ۱۹۸۳ توسط گراهام هیوز معرفی شد و گاه به عنوان سندرم هیوز شناخته میشود. کشف این سندرم از مشاهده نتایج مثبت کاذب آزمایش سیفلیس در بیماران مبتلا به لوپوس آغاز شد که به شناسایی آنتیبادیهای آنتیکاردیولیپین و لوپوس آنتیکواگولانت منجر شد. شیوع جهانی سندرم APS حدود ۴۰ تا ۵۰ مورد در هر ۱۰۰ هزار نفر است و نرخ بروز سالانه آن ۱ تا ۲ مورد در هر ۱۰۰ هزار نفر برآورد میشود. زنان بیشتر از مردان تحت تاثیر این سندرم قرار میگیرند، به طوری که نسبت شیوع زن به مرد ۳.۵ به ۱ است و سن اوج بروز این بیماری معمولاً پس از ۵۵ سالگی مشاهده میشود.
در ایران، بر اساس مطالعهای که بین سالهای ۲۰۰۸ تا ۲۰۱۸ بر روی ۲۸۴ بیمار در شهر مشهد انجام شد، مشخص گردید که ۸۵.۶ درصد بیماران زن و میانگین سن تشخیص این بیماری در بیماران ایرانی ۳۸ سال است. همچنین، این تحقیق نشان داد که ۴۷.۲ درصد بیماران مبتلا به APS اولیه بودند (بهمعنای عدم وجود بیماری زمینهای) و ۵۲.۸ درصد موارد APS ثانویه، بهویژه همراه با لوپوس اریتماتوی سیستمیک (SLE) مشاهده شده است.
در میان کودکان، سندرم APS دارای توزیع جنسیتی متعادلتر است و خطر ترومبوز مکرر در آنها بالاتر گزارش شده است. عوامل خطر اصلی بروز این بیماری شامل حضور بیماریهای خودایمنی دیگر، ابتلا به عفونتها و تأثیرات ژنتیکی میباشد.
علایم و تظاهرات بالینی
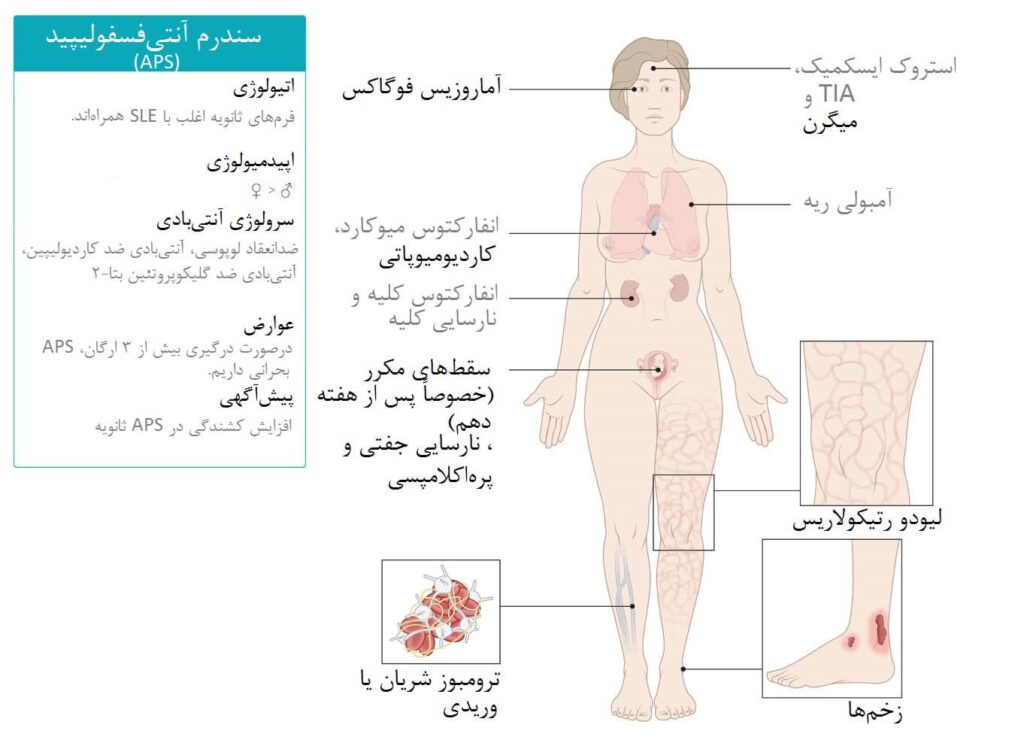
APS میتواند بدون علامت باشد تا زمانی که یک رویداد ترومبوتیک یا عارضه بارداری رخ دهد. علایم اصلی شامل ترومبوز وریدی یا شریانی در هر اندامی است. ترومبوز وریدی اغلب در اندامهای تحتانی (مانند ترومبوز وریدی عمیق منجر به آمبولی ریوی) رخ میدهد، در حالی که ترومبوز شریانی معمولاً در مغز (سکته ایسکمیک یا حمله گذرای ایسکمیک) دیده میشود. سایر محلها شامل ترومبوز در اندام فوقانی، سندرم بود-کیاری، ترومبوز سینوس ساژیتال، شریانهای شبکیه، براکیال، کرونری، مزانتریک و محیطی است. شیوع تجمعی سکته ۱۹.۸ درصد و TIA ۱۱.۱ درصد است. در ایران، DVT و CVA هر کدام ۱۳ درصد موارد را تشکیل میدهند.
در بارداری، علایم شامل مرگ جنین پس از هفته ۱۰، زایمان زودرس پیش از هفته ۳۴ به دلیل پرهاکلامپسی شدید یا نارسایی جفت، چندین سقط جنین پیش از هفته ۱۰، دیسترس جنینی، محدودیت رشد داخل رحمی، جداشدگی جفت و سندرم HELLP است. در ایران، سقط زیر ۱۰ هفته ۶۸.۱ درصد موارد بارداری را شامل میشود. تظاهرات غیرمعیاری شامل:
- پوستی: لیودو رتیکولاریس (شایع اما غیراختصاصی، شیوع ۲۵ درصد در APS اولیه و ۷۰ درصد در APS همراه SLE، عامل پیشبینیکننده بد برای بیماری شدید)، زخمهای پوستی شبیه پیودرما گانگرنوزوم، انفارکتوسهای ناخنی، گانگرن دیجیتال، ترومبوفلبیت سطحی، پورپورای نکروزان. در ایران، ۱۹.۷ درصد بیماران تظاهرات غیرمعیاری مانند آرترالژی (۳۷.۷ درصد) و آرتریت (۳۳.۱ درصد) دارند.
- قلبی-عروقی: ضخامت، ندولها یا وژتاسیون روی دریچههای میترال/آئورتیک (شیوع تا ۸۰ درصد)، منجر به رگورژیتاسیون یا استنوز؛ انفارکتوس میوکارد (۵.۵ درصد)، آمبولیهای قلبی. فشار خون ریوی دو برابر ریسک دارد.
- هماتولوژیک: ترومبوسیتوپنی (۱۵-۴۲ درصد موارد، به ندرت شدید با خونریزی؛ شیوع حداقل ۳۰ درصد در ایران)، آزمایش کومبس مثبت (همولیز نادر). در ایران، ۱۷.۶ درصد بیماران ترومبوسیتوپنی دارند.
- عصبی: رویدادهای ایسکمیک گذرا، سکته (تکراری منجر به اختلال شناختی، تشنج، دمانس مولتیانفارکت)، کوری از انسداد شریان/ورید شبکیه، ناشنوایی ناگهانی، سردردهای مقاوم، میگرن، کوریا. aPL ریسک بیماری عروقی مغز را ۵.۴۸ برابر در افراد زیر ۵۰ سال افزایش میدهد. در ایران، تشنج ۱۰.۹ درصد موارد دیده میشود.
- ریوی: ترومبوآمبولی ریوی (۱۴ درصد)، خونریزی منتشر ریوی از کاپیلاریتیس.
- کلیوی: فشار خون بالا، پروتئینوری، نارسایی کلیه از میکروآنژیوپاتی ترومبوتیک، ترومبوز شریان کلیوی.
- سندرم فاجعهبار APS (CAPS): ترومبوز چنداندامی (میکرو/ماکروواسکولار)، شامل ترومبوز محیطی، عوارض ریوی (مانند سندرم دیسترس تنفسی حاد، آمبولی، خونریزی)، نارسایی کلیه، ایسکمی/گانگرن/زخم پوستی، سکته/انسیفالوپاتی مغزی، ضایعات دریچه قلبی/انفارکتوس/نارسایی، ترومبوسیتوپنی، انفارکتوس گوارشی. عوامل تحریککننده شامل قطع آنتیکواگولاسیون، عفونتها، جراحی. مرگ و میر حدود ۴۸-۵۰ درصد، بالاتر با درگیری SLE یا قلبی/ریوی/کلیوی/طحالی. کمتر از ۱ درصد APS، اما ۵۰ درصد موارد اولیه APS است. در بارداری، CAPS میتواند منجر به انفارکتوس مغزی با تحول هموراژیک شود.
در ایران، مطالعات تأکید بر تظاهرات عصبی مانند اختلالات شناختی و سردردهای مقاوم و قلبی مانند نارسایی دیاستولیک دارند. همچنین، گانگرن اندام ۷.۴ درصد و PTE ۴.۶ درصد موارد است. در کودکان، تظاهرات شامل ترومبوسیتوپنی و کواگولوپاتی است.
نحوه تشخیص آزمایشگاهی
تشخیص آزمایشگاهی این شرایط مستلزم تأیید مداوم حضور آنتیبادیهای فسفولیپید (aPL) همراه با شواهد بالینی، مانند ترومبوز یا عوارض بارداری، است. آزمایشهای مورد استفاده شامل موارد زیر میشوند.
- لوپوس آنتیکواگولانت: این آزمونهای عملکردی مثل افزایش زمان aPTT یا تست زمان سم مار راسل رقیقکننده (dRVVT) در نبود فسفولیپید انجام میشوند و با فسفولیپیدهای اضافی اصلاح میشوند. این آزمایش بیشترین ارتباط را با عوارض بارداری داشته و بسیار اختصاصی است؛ اما حساسیت کمتری نسبت به آنتیکاردیولیپین برای تشخیص ترومبوز دارد. مثبت شدن LAC در ایران حدود 18.3 درصد گزارش شده است.
- آنتیکاردیولیپین (aCL): این آنتیبادیها (IgG و IgM) با روش ELISA و تیتر بالاتر از 40 GPL/GML یا بالاتر از صدک 99 تشخیص داده میشوند. آمارهای ایران نشان میدهند که 37.3 درصد IgM و 30 درصد IgG مثبت بودهاند.
- آنتی-β2 گلیکوپروتئین I (β2GPI): سنجش IgG و IgM این آنتیبادیها نیز توسط ELISA با تیتر بالاتر از صدک 99 صورت میگیرد. در ایران، IgM مثبت 59.2 درصد و IgG مثبت حدود 15 درصد گزارش شده است.
برای تأیید پایداری آزمایشها، باید این آزمایشها حداقل با فاصله زمانی 12 هفته تکرار شوند تا احتمال وجود آنتیبادیهای موقت یا کم خطر رد شود. اگر فاصله بین رویدادهای بالینی و انجام آزمایشها بیش از پنج سال باشد، ممکن است در تشخیص شک ایجاد شود. نشانههای دیگر شامل ترومبوسیتوپنی، آنمی، مشکلات کلیوی همچون پروتئینوری، افزایش ESR به عنوان فاز التهابی حاد و سایر موارد میشود. البته در غیاب التهاب فعال، نشانگرهای التهابی معمولاً طبیعیاند. در افراد مبتلا به SLE، آزمونهای دیگر مانند ANA مثبت (در ایران 51.8 درصد موارد)، anti-dsDNA و anti-Smith ارزیابی میشوند، اما حضور هیپوکمپلمانمی نشاندهنده نفریت لوپوسی خواهد بود. باید سایر وضعیتهای هیپرکوآگولابل، از جمله هیپرهوموسیستئینمی، فاکتور V لیدن، یا کمبود پروتئین C/S/آنتیترومبین، رد شوند. LAC ممکن است باعث مداخله در نتایج آزمایش (مانند افزایش aPTT، PT یا INR) شود. در این موارد سنجش مستقیم فعالیت پروترومبین یا فاکتور X پیشنهاد میشود. در ایران برای جلوگیری از نتایج کاذب، استفاده از پلاسمای بدون پلاکت با روش دوگانه سانتریفیوژ توصیه شده و برای بیماران تحت درمان با وارفارین، از تستهای مبتنی بر سم مار تایپان استفاده میشود. وجود سه تست مثبت بهطور همزمان (تریپل پوزیتیو) ارتباط قوی با ترومبوز دارد. همچنین، IgM نسبت به IgG ترومبوژنیکتر است و آنتیبادی IgA کمتر شایع است. برخی آزمونهای غیراستاندارد نظیر anti-ANXA5 ممکن است ریسک عوارض شریانی و وریدی را افزایش دهند (با نسبت شانس 2.60 تا 2.80). در ایران مشخص شده که وجود آنتی-β2GPI IgG خطر نارسایی پلاسنتال را تا 4.3 برابر افزایش میدهد.
ژنتیک بیماری
علت دقیق ژنتیکی سندروم آنتیفسفولیپید (APS) هنوز بهطور کامل مشخص نشده است، اما مطالعات نشان میدهند که پلیمورفیسمهای موجود در برخی ژنها، از جمله TSHR، C1D، آلل T از پلیمورفیسم SNP ژن STAT4، و نیز Val247، افراد را مستعد تولید آنتیبادیهای ضدفسفولیپید (aPL) میکند. هرچند اکثر موارد این سندروم به صورت اسپورادیک مشاهده میشوند و شیوع آن در میان خانوادهها نادر است، الگوی وراثتی دقیقی برای آن شناسایی نشده است. به نظر میرسد که ترکیبی از عوامل ژنتیکی چندگانه و تأثیرات محیطی میزان خطر ابتلا را تعیین میکنند.
انواع خاصی از ژنهای HLA، ازجمله DR7، DR4، DRw53 و DQw7، همچنین آللهای null مربوط به C4، با این بیماری مرتبط شناخته شدهاند. علاوه بر این، جهشهایی در ژنهای مرتبط با فاکتورهای انعقادی میتوانند خطر ابتلا به حوادث ترومبوتیک را افزایش دهند. مطالعات اخیر ژنومی و اپیژنتیکی پیشرفتهای قابل توجهی در درک مکانیزمهای مرتبط با عروق و بارداری ارائه کردهاند؛ این تحقیقات بیشتر بر ژنهای ایمنی مانند IRF5 و HLA-DR4 متمرکز بودهاند. همچنین، جهشهایی در ژنهای تنظیمکننده سیستم کمپلمان نقش مهمی در افزایش خطر بروز سندروم آنتیفسفولیپید کاتاستروفیک (CAPS) ایفا میکنند.
در ایران، تحقیقات علمی عمدتاً بر بررسی نقش عوامل ژنتیکی در همراهی APS با برخی دیگر از بیماریهای خودایمنی تمرکز دارند. با این حال، مطالعات اختصاصی و جامع ژنتیکی در این زمینه محدود باقی مانده است.
مشاوره ژنتیک
اگرچه سندرم آنتیفسفولیپید (APS) عموماً غیروراثتی تلقی میشود، ارائه مشاوره به افرادی که دارای سابقه خانوادگی ترومبوز هستند یا بهعنوان حاملین آنتیبادیهای ضدفسفولیپید (aPL) بدون نشانههای بالینی تشخیص داده شدهاند، از اهمیت ویژهای برخوردار است. حاملین، بهویژه کسانی که دارای تست سهگانه مثبت (تریپل پوزیتیو) هستند، در معرض خطر بالاتری برای ابتلا به ترومبوز قرار دارند. این مشاوره معمولاً شامل ارزیابی جامع خطر، غربالگری گسترده خانواده برای شناسایی aPLها و پیشنهاد راهبردهای پیشگیری، نظیر مصرف آسپرین در موارد با خطر بالا، میشود. در موارد نادر که ارتباط خانوادگی آشکاری وجود دارد، بررسی ژنتیکی با هدف شناسایی پلیمورفیسمهای مرتبط پیشنهاد میشود، هرچند تا کنون هیچ ژن معینی برای استفاده در آزمایشهای روتین معرفی نشده است. در این میان، توجه خاص به عوامل محیطی و همابتلاییها، از جمله لوپوس اریتماتوز سیستمیک (SLE)، حائز اهمیت است. علاوه بر این، در دوران بارداری، مشاوره ژنتیکی نقش مؤثری در ارزیابی خطر عوارض مرتبط ایفا میکند.
الگوریتم تشخیص
الگوریتم تشخیص شامل مراحل زیر است:
- در موارد مشکوک به سندرم آنتیفسفولیپید (APS)، در صورت بروز ترومبوز غیرقابل توضیح (شریانی یا وریدی) یا عوارض بارداری، بهویژه در بیماران جوان بدون عوامل خطر مشخص، بررسی آغاز میشود.
- معیارهای بالینی، شامل شواهد تصویربرداری یا هیستوپاتولوژیک برای ترومبوز و همچنین ارزیابی عوارض بارداری از طریق سونوگرافی یا معاینات مرتبط، باید تأیید شوند.
- در مرحله آزمایشگاهی، وجود آنتیبادیهای aPLبررسی میشود.
- آزمایشها برای تأیید پایداری نتایج با فاصله حداقل ۱۲ هفته تکرار میشوند.
- بررسی علل گذرا، سایر شرایط هیپرکواگولابلیتی، عفونتها و تأثیر احتمالی داروها ضروری است.
- طبقهبندی APS به دو نوع اولیه (بدون شواهد خودایمنی) و ثانویه (مانند همراهی با SLE) انجام میشود؛ همچنین انواع ترومبوتیک، بارداری یا CAPS مشخص میگردند.
- معیارهای تشخیصی ساپورو (۲۰۰۶) با ترکیب حداقل یک معیار بالینی و یک آزمایشگاهی ارائه میشوند.
در خصوص CAPS: معیارها شامل درگیری همزمان حداقل سه اندام (در کمتر از یک هفته)، تأیید هیستوپاتولوژیک انسداد و مثبت بودن آزمایش aPL است؛ تشخیص قطعی نیازمند وجود هر چهار ویژگی بوده و در صورت وجود سه معیار، احتمال بالا مطرح میشود. برای پیشبینی ریسک ترومبوز از امتیاز GAPSS استفاده شده که بازه ۰ تا ۲۰ دارد؛ امتیاز ۱۶ یا بالاتر بیانگر ریسک بالا است.
تشخیص افتراقی
- ترومبوز: هیپرهوموسیستئینمی، جهش فاکتور V Leiden/پروترومبین، کمبود پروتئین C/S/آنتیترومبین III.
- نفروپاتی APS: پورپورای ترومبوتیک ترومبوسیتوپنیک، واسکولیت، سندرم همولیتیک اورمیک، فشار خون بدخیم، نفریت لوپوس (تأیید با بیوپسی کلیه).
- CAPS: DIC، HIT، TMA، سپسیس، HELLP.
- سایر: SLE، آرتریت روماتوئید، عفونتها (ویروس/باکتری القاکننده aPL)، بدخیمیها، القایی دارویی (مانند کلرپرومازین، پروکائینآمید).
درمان
درمان براساس علائم مشخص شده متغیر است و هدف اصلی جلوگیری از ترومبوز و از دست رفتن بارداری است. پیشگیری اولیه شامل استفاده از آسپیرین با دوز پایین (۷۵-۱۰۰ میلیگرم) برای بیماران با aPL پرریسک، مانند LAC مثبت، تریپل مثبت یا بیماران مبتلا به SLE بدون سابقه ترومبوز است. همچنین، هیدروکسیکلروکین بهویژه برای مبتلایان به SLE توصیه میشود. آسپیرین توانایی کاهش ریسک اولین رخداد ترومبوز را تا ۵۰ درصد دارد. در پیشگیری ثانویه، موارد وریدی با استفاده از وارفارین (با INR ۲.۰-۳.۰ و پل هپارین) مدیریت میشوند که این درمان مادامالعمر برای رویدادهای بدون تحریک الزامی است. استفاده از DOACها مانند ریواروکسابان یا آپیکسابان نیز در موارد وریدی تک یا دبل پوزیتیو امکانپذیر است، اما باید از کاربرد آنها در تریپل مثبت، شریانی یا APS همراه با ترومبوز اجتناب کرد، زیرا ریسک شریانی به طور قابل توجهی بالاتر از وارفارین است. در موارد شریانی، وارفارین با INR بین ۲.۰ تا ۳.۰ اولویت دارد و در موارد مکرر ممکن است نیاز به INR بالاتر باشد. اگر بیمار تحمل آن را نداشته باشد، استفاده از LMWH پیشنهاد میشود و در موارد مکرر افزودن آسپیرین، LMWH یا بالا بردن INR ضروری است. مدیریت بارداری نیز بسته به شرایط متفاوت است. برای بیماران بدون سابقه، درمانی برای بارداری اول یا سقط زودرس تنها ضرورتی ندارد و فقط برای بیماران پرریسک آسپیرین دوز پایین توصیه میشود. برای مواردی که ≥۳ سقط زودرس یا سقط دیررس اتفاق افتاده، ترکیب آسپیرین دوز پایین با LMWH یا هپارین پروفیلاکتیک به کار میرود که باید قبل از بارداری آغاز شده و ۶ تا ۱۲ هفته پس از زایمان ادامه یابد. برای موارد مقاوم، اضافه کردن هیدروکسیکلروکین ضروری است که میتواند احتمال تولد زنده را افزایش دهد. در موارد زایمان زودرس زود، آسپیرین ± هپارین پروفیلاکتیک تجویز میشود. برای بیماران با سابقه ترومبوتیک، استفاده همزمان از آسپیرین دوز پایین و هپارین درمانی توصیه میشود. در بیماران با تکرار رخداد علیرغم درمان، هپارین درمانی همراه با هیدروکسیکلروکین، پردنیزولون یا IVIG در موارد انتخابی پیشنهاد میشود. همچنین انتقال از وارفارین به هپارین در مراحل ابتدایی بارداری الزامی است. پس از زایمان، ادامه آنتیکواگولاسیون حداقل تا ۶ هفته لازم است و در برخی موارد برای جلوگیری از استیلبیرث استفاده از IVIG پیشنهاد میشود.
پروگنوز
بقای دهساله در بیماران 90 تا 94 درصد است، اما میزان موربیدیتی بالاست: بیش از 30 درصد آسیب دائمی اندام و بیش از 20 درصد ناتوانی شدید مشاهده میشود. ویژگیهای نامطلوب شامل CAPS، فشار خون ریوی، نفروپاتی، درگیری سیستم عصبی مرکزی و گانگرن است. این موارد در APS اولیه و ثانویه مشابهاند، اما نوع ثانویه با همابتلاییها (مانند SLE که خطر عوارض نوروپسیکیاتریک را افزایش میدهد) پیشآگهی بدتری دارد. افزایش آنتیبادیهای aPL در کنار بدخیمیها نشاندهنده پروگنوز ضعیف است. در بیماران مبتلا به COVID-19، حدود 50 درصد موارد aPL مثبت (عموماً LAC) گزارش شده، اما اغلب با افزایش خطر ترومبوز همراه نیست. مطالعات اخیر نشان دادهاند که استفاده از DOACها در بیماران APS سهگانه مثبت یا با ترومبوز شریانی مناسب نیست. در ایران علیرغم نرخ پایین مرگومیر (1.8 درصد)، شیوع بالای ترومبوز و سقط مشاهده میشود. اگرچه APS معمولاً یک بیماری مادامالعمر است، با مدیریت مناسب افراد میتوانند بارداری موفق داشته باشند و زندگی عادی را دنبال کنند.
جدول خلاصه علایم و درمان APS
دستهبندی | علایم شایع | درمان پیشنهادی | شیوع تقریبی |
| ترومبوز وریدی | درد پا، آمبولی ریوی | وارفارین (INR ۲-۳) یا هپارین | ۲۰-۳۰ درصد |
ترومبوز شریانی | سکته مغزی، انفارکتوس قلبی | وارفارین با INR بالاتر اگر مکرر | ۱۹.۸ درصد سکته |
عوارض بارداری | سقط مکرر، پرهاکلامپسی | آسپیرین + هپارین دوز پایین | ۶ درصد بارداریها |
تظاهرات غیرمعیاری | لیودو رتیکولاریس، ترومبوسیتوپنی | نظارت و درمان علامتی (کورتیکواستروئید اگر شدید) | ۱۵-۴۲درصد ترومبوسیتوپنی |
CAPS | چنداندامی، نارسایی کلیه/ریوی | هپارین + IVIG + تعویض پلاسما | >۱ درصد |
در نهایت، APS یک بیماری قابل مدیریت است اگر زود تشخیص داده شود.
Reference:
http://1. سندرم آنتی فسفولیپید (APS) – مرکز روماتیسم ایران
http://2. سندرم آنتیفسفولیپید (APS)
http://3. https://pmc.ncbi.nlm.nih.gov/articles/PMC10364614/
http://4. https://www.acrconvergencetoday.org/acr-eular-develop-new-aps-classification-criteria/
http://5. https://pubmed.ncbi.nlm.nih.gov/36866678/
http://6. https://onlinelibrary.wiley.com/doi/10.1111/bjh.19635
http://8. https://medicine.umich.edu/sites/default/files/content/downloads/Madison.pdf
http://9. https://www.jthjournal.org/article/S1538-7836%2824%2900240-X/fulltext
http://10. https://pubmed.ncbi.nlm.nih.gov/39064231/
http://11. https://emedicine.medscape.com/article/333221-treatment
http://12. https://pmc.ncbi.nlm.nih.gov/articles/PMC7236388/
http://13. https://parsgenomelab.com/mag/antiphospholipid-syndrome/
http://14. https://resaa.net/blog/antiphospholipid-syndrome/
http://18. https://daneshyari.com/isi/articles/antiphospholipid_syndrome
http://20. https://mom.ir/blog/pregnancy/Antiphospholipid-syndrome-pregnancy
http://21. https://civilica.com/doc/840055/